Científicos de la Facultad de Medicina Duke-NUS han identificado un gen que controla el comportamiento de un tipo específico de macrófago cardíaco, responsable de la cicatrización excesiva en las primeras fases de las cardiopatías comunes o cardiomiopatías (diversas enfermedades del músculo cardíaco). Cuando se bloquea el gen denominado WW P2 (una proteína ligasa ubiquitina E3), la función cardiaca mejora y la formación de tejido cicatricial se ralentiza, lo que frena la progresión de la insuficiencia cardiaca.
Función de WWP2 en las enfermedades fibróticas
La cicatrización o fibrosis del corazón, como en las miocardiopatías no isquémicas, es una afección progresiva y un problema de salud mundial», afirma el profesor asociado Enrico Petretto, director del Centro Duke-NUS de Biología Computacional y genetista de sistemas del programa de Enfermedades Cardiovasculares y Metabólicas (CVMD) de la Facultad.»En sus etapas más tempranas, se caracteriza por una fase inflamatoria, por lo que la intervención en este punto podría retrasar significativamente la progresión de la enfermedad»
Petretto y sus colegas de Singapur, China y el Reino Unido llevan varios años estudiando la función de la WWP2 en las enfermedades fibróticas y descubrieron por primera vez que es un impulsor clave de la formación de cicatrices cuando se expresa en los fibroblastos, las células que forman el tejido cicatricial. En sus últimos hallazgos, publicados en Nature Communications, el equipo se centró en las primeras fases de la enfermedad.
Los macrófagos que expresan WWP2 favorecen la formación de cicatrices
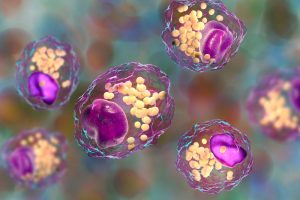
Mediante la secuenciación unicelular del ARN, el equipo descubrió que, cuando se desencadena la fibrosis, se activan diversos macrófagos, células inmunitarias encargadas de eliminar los cuerpos extraños del organismo, en un modelo preclínico de cardiopatía. Aunque los macrófagos son más conocidos por su función de eliminación de células cancerosas, microbios y restos celulares, también ayudan a regenerar las células musculares sanas.
Sin embargo, un subconjunto de estos macrófagos cardíacos está controlado por WWP2. Estos macrófagos que expresan WWP2 promueven activamente la formación de cicatrices al inducir a las células cardiacas locales (fibroblastos) a producir colágeno de forma descontrolada, lo que favorece la formación de tejido cicatricial. Los investigadores descubrieron que: «Cuando la WWP2 se expresa en macrófagos, estas células «irritan» a los fibroblastos, lo que provoca la formación descontrolada de cicatrices».
Una pequeña molécula inhibidora bloquea la WWP2
En cambio, cuando los macrófagos no expresaban WWP2, el equipo observó una menor infiltración de macrófagos profibróticos en el corazón y se mantuvo mejor el efecto de los macrófagos reparadores, con claros efectos beneficiosos sobre el tejido cardiaco y la función cardiaca en las últimas fases de la enfermedad.
«Atacar la WWP2 es como arrojar una manta sobre el fuego: priva a las llamas de oxígeno antes de que arda toda la casa», explicó el profesor asociado de biología de sistemas del programa CVMD Jacques Behmoaras, coautor del estudio. Bloquear la función de WWP2 en este subconjunto de macrófagos cardiacos basta para ralentizar o incluso detener la cicatrización».
El equipo está desarrollando una pequeña molécula inhibidora de la WWP2 que puede hacer precisamente eso. En lugar de eliminar indiscriminadamente todos los macrófagos, lo que ha demostrado tener efectos nocivos, el equipo Duke-NUS se dirige a WWP2, que actúa específicamente sobre estos macrófagos profibróticos y fibroblastos activados para detener la cicatrización del corazón dañado.
Potencial terapéutico prometedor
«Dado que WWP2 desempeña un doble papel en la formación de tejido cicatricial, su bloqueo, al frenar la inflamación y la cicatrización a la vez, mata dos pájaros de un tiro. Y con su ventaja añadida de promover los macrófagos beneficiosos para la reparación tisular, WWP2 se convierte en una diana terapéutica muy atractiva».
Los investigadores están creando pequeñas moléculas inhibidoras dirigidas a una forma específica de la proteína WWP2, que ya han mostrado resultados antifibróticos prometedores en células. Postulan que esto podría tener potencial terapéutico para tratar enfermedades fibróticas como las cardiomiopatías no isquémicas, y podría resultar eficaz en otras enfermedades fibróticas en las que intervenga la WWP2.